選單

FDA Logo僅供官方使用,任何私自使用可能對大眾傳遞錯誤訊息,誤以為FDA對某件事物的認可。未經授權的使用FDA Loge可能違反聯邦法律,承擔民事和(或)刑事責任。
The FDA logo is for the official use of the U.S. Food and Drug Administration (FDA) and not for use on private sector materials. To the public, such use would send a message that FDA favors or endorses a private sector organization or the organization’s activities, products, services, and/or personnel (either overtly or tacitly), which FDA does not and cannot do. Unauthorized use of the FDA logo may violate federal law and subject those responsible to civil and/or criminal liability.
原文網址: https://www.fda.gov/about-fda/website-policies/fda-logo-policy
由於醫療防護物品需求大增,FDA也特別對”證書”做出聲明,我們在這教大家怎麼做判斷。 坊間的FDA證書,是由代理單位出具的結案聲明,好比一張收據,上面描述案件的註冊內容。 初次接觸的客戶容易被誤導,因為有些代理公司使用了FDA的Logo,或是千奇百怪的暗示,然而,未經授權的使用FDA Loge可能違反聯邦法律,承擔民事和(或)刑事責任。 各位只需要看最底下的簽屬公司,就知道是不是FDA發的啦。
FDA does not issue Registration Certificates to medical device establishments. FDA does not certify registration and listing information for firms that have registered and listed. Registration and Listing does not denote approval or clearance of a firm or their devices.

• 醫療設備定義
意指儀器、器械、工具、機器、配件、植入物、體外試劑或其他類似或相關的物品,該物品是用於診斷、治愈、緩解、治療或預防人類疾病或動物疾病的設備。
• 醫療設備的分級
FDA醫療設備所涉及的範圍很廣,從簡單的便盆到複雜的起搏器皆涵蓋在內,他們將每一種醫療器械都明確規定其產品分類和管理要求,目前FDA醫療器械產品目錄中有上千種。任何一種醫療器械想要進入美國市場,必須先弄清申請上市產品分類和管理要求。根據不同的風險等級,FDA將醫療設備分為Ⅰ類低風險,Ⅱ類中風險及Ⅲ類高風險,風險等級越高,所受的監督越嚴格。
Class I低風險:危險性小或是沒有危險性之產品,這類產品只需實行一般控制(General Control),如:醫療配件、眼鏡框、眼鏡片、牙刷等...。
Class II中風險:除了要符合一般控制外,還需實行特殊控制(Special Control),必須先通過上市前通知(PMN)後,才可進行註冊,如:宣稱可過濾95%細菌or病毒之N95口罩,醫用手套等...。
Class III高風險:此分類多為侵入人體或是維持生命之器材,對人體具有潛在的風險,這些器材都必須經過上市前許可(PMA)後才能銷售。
大部分I類設備是實行一般控制(General Control),只需要支付FDA年費,並進行企業註冊與產品列名即可於美國上市,但請注意,並非所有I類設備都可以豁免510(K)。
大部分II類設備是實行特殊控制(Special Control),需撰寫510(K)審查文件,申請人或公司必須將欲申請上市的醫療設備與已在美國FDA上市之一種或多種相似醫材做比對,證明其具有相同的安全性與有效性(=實質等同,Substantial Equivalence,SE),此份文件並沒有一定的格式,需有邏輯性且架構清楚的說明。但有少數產品雖為II類,仍可豁免510(K)。
需準備的有:

申請流程.jpg)
• 申請時間:
已豁免510(K)之醫療設備,只需要進行註冊列名,資料齊全後,申請時間大約1~2週左右即可完成。
而510(K)申請時間大約落在3~8個月不等,要視申請者資料是否齊全與FDA審查而定。
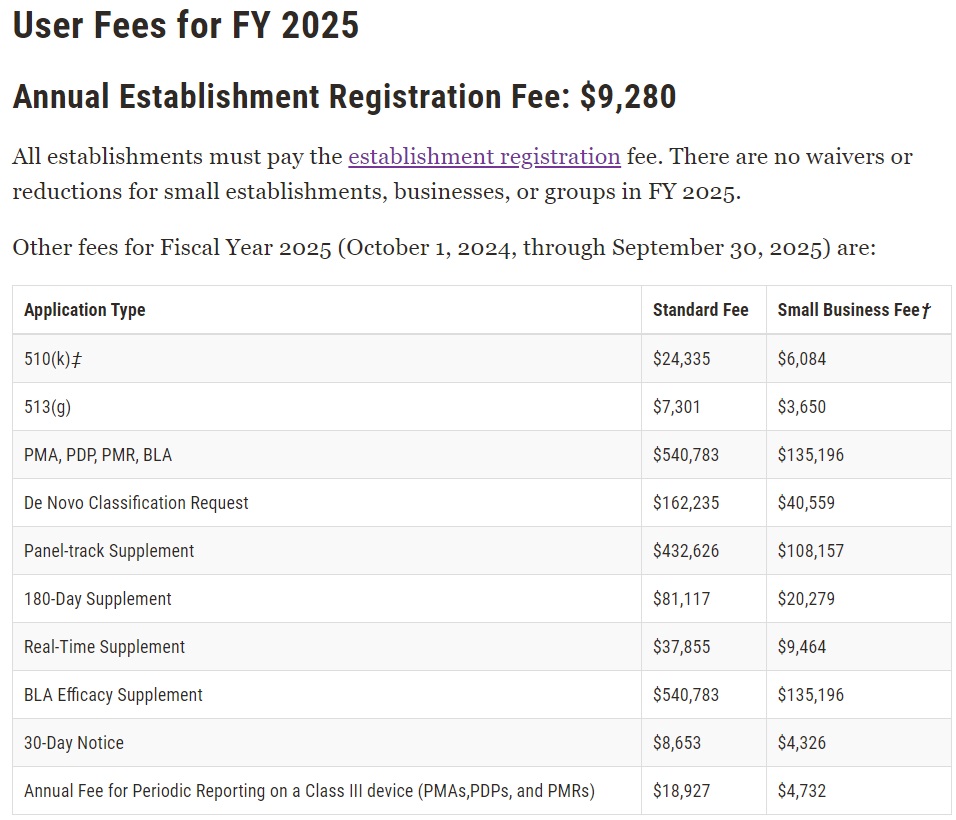
• 註冊費用:(2024/10/1~2025/9/30)
• 甚麼是DUNS:
鄧白氏企業認證™ (D-U-N-S® Registered™)為全球企業提供國際通用的專屬身份,企業接受鄧白氏的資訊收集和審核後,被授予鄧白氏環球編碼® (D-U-N-S Number®, ,全稱Data Universal Numbering System),由鄧白氏創立的9位數全球編碼系統,建檔於鄧白氏全球企業資料庫,並安裝經權威認證的鄧白氏企業認證™(D-U-N-S® Registered™)電子標章。
• 如何取得?
請聯繫「美商鄧白氏股份有限公司台灣分公司」
Tracy謝小姐,Email: hsiehtracy@dnb.com

FDA註冊完成後,會優先取得產權人識別號(Owner Number)與設備註冊號(Device List Number) ,並可於FDA公開資料庫中查詢,而註冊號(Registration Number)將由FDA內部於90天內發放。
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
您也許會看到坊間有各形各色的FDA證書,這些證書並非由FDA官方頒布,而是註冊單位自行製作。請參閱 貳、FDA註冊的證書是真是假?
只要是在美國銷售的醫療設備,所有關於製造、銷售的業者都需註冊。
例如: 製造商、代工廠、品牌商、出口商
Establishments that are involved in the production and distribution of medical devices intended for commercial distribution in the United States (U.S.), including those that are imported for export only, are required to register annually with the FDA.

• 化妝品之定義:
聯邦食品、藥品和化妝品法(FD&C Act)依預定使用目的,將化妝品定義為「擦、倒、噴、灑或其他等方式使用於人體之任何部位…用以清潔、美容、增進吸引力或改變外觀之物品」,包括保濕水、香水、唇膏、指甲油、眼睛和臉部化妝品、洗髮精、燙髮劑、染髮劑和除臭劑,以及預定作為化妝品成份使用之任何物質。
• 藥品之定義:
FD&C Act 依據預定使用目的,將部份藥品定義為「預定使用於診斷、治療、減緩、處理或預防疾病或意在影響身體的結構或功能所使用的產品 (不包括食品)」,非處方藥係指不須經醫師處方籤即可購買之藥品。且該物品必須可直接使用在人體,一般常見的非處方藥如:抗菌乾洗手、抗菌濕紙巾、防曬乳等…
• 同時為化妝品與藥品之定義:
同時符合化妝品與藥品可能發生於產品有兩種預定使用目的時。例如,洗髮精因其預定使用目的為清潔頭髮而被認定是化妝品;去屑配方因預定使用目的為去頭皮屑而被認定為藥品。因此,去屑洗髮精即同時為化妝品和藥品。其他如含氟牙膏、止汗香氛噴霧等…皆須同時符合藥品與化妝品規定。
綜上所述,若您的產品宣稱療效,如:抗菌、抗病毒、除疤、抗痘等,就屬於OTC範疇;反之,若不宣稱療效,即可當作化妝品,可註冊VCRP。確認產品可申請非處方藥之後,就必須要判斷產品的有效成分,是否有在FDA OTC Active Ingredients列表中,若成份有在列表中,並且符合對應的Monograph,即可註冊為OTC非處方藥。
需準備的有:

• 申請時間:資料齊全後,約3-4週可完成註冊。
• 申請費用:
• 甚麼是DUNS:
鄧白氏企業認證™ (D-U-N-S® Registered™)為全球企業提供國際通用的專屬身份,企業接受鄧白氏的資訊收集和審核後,被授予鄧白氏環球編碼® (D-U-N-S Number®, ,全稱Data Universal Numbering System),由鄧白氏創立的9位數全球編碼系統,建檔於鄧白氏全球企業資料庫,並安裝經權威認證的鄧白氏企業認證™(D-U-N-S® Registered™)電子標章。
• 如何取得?
請聯繫「美商鄧白氏股份有限公司台灣分公司」
Tracy謝小姐,Email: hsiehtracy@dnb.com

註冊完成後會取得十碼組成的NDC(National Drug Code),並且可於公開資料庫中查詢。
https://www.accessdata.fda.gov/scripts/cder/ndc/index.cfm
從事製造,重新包裝,重新貼標籤的廠商,都必須向FDA註冊。
Domestic and foreign establishments that manufacture, repack, or re-label drug products in the United States are required to register with the FDA. Domestic and foreign drug manufacturers, repackers or re-labelers are also required to list all of their commercially marketed drug products. This information helps the FDA maintain a catalog of all drugs in commercial distribution in the United States.
• 申請時間:資料齊全後,約1週左右即可完成食品FFR註冊
• 申請費用:
自2020/10/1起,食品註冊需提供DUNS號碼
• 甚麼是DUNS:
鄧白氏企業認證™ (D-U-N-S® Registered™)為全球企業提供國際通用的專屬身份,企業接受鄧白氏的資訊收集和審核後,被授予鄧白氏環球編碼® (D-U-N-S Number®, ,全稱Data Universal Numbering System),由鄧白氏創立的9位數全球編碼系統,建檔於鄧白氏全球企業資料庫,並安裝經權威認證的鄧白氏企業認證™(D-U-N-S® Registered™)電子標章。
• 如何取得?
請聯繫「美商鄧白氏股份有限公司台灣分公司」
Tracy謝小姐,Email: hsiehtracy@dnb.com

註冊完成後會取得FFR號碼(Food Facility Registration Number)與Pin Number,若為低酸/酸化之罐頭食品另會取得FCE & SID號碼,FDA食品註冊無公開資料庫可供查詢。
根據美國食品與藥物管理局(Food and Drug Administration,簡稱 FDA)按照《生物恐怖主義法案》(Bioterrorism Act) 頒佈之規定,從2003年12月12日起,任何進口到美國的人類和其他動物用食品必須事先通知FDA,除非該食品免於事先通知。
Prior Notice可以使用以下方式之任1種提交電子申請:
透過FDA PNSI申請者,需於到達15日內提出,截止申請時間視運輸之方式不同而有所差異:
Prior Notice must be provided for all food for humans and animals that is imported or offered for import into the United States.
Prior Notice must be submitted electronically through either of the following systems:
原文網址:
https://www.fda.gov/food/importing-food-products-united-states/filing-prior-notice-imported-foods
在美國銷售的生產、加工、包裝或儲存食品、飲料、膳食補充品的所有設施,都必須在FDA註冊。
FDA已於2023/3/27停止使用VCRP,為擴大對化妝品的管理,必須遵循化現行化妝品MoCRA法案,法案中新增了不良事件報告、強制召回權、紀錄保存、安全證實、遵守GMP、香料過敏原標籤揭露等…
(詳情請參考FDA官網:
https://www.fda.gov/cosmetics/cosmetics-laws-regulations/modernization-cosmetics-regulation-act-2022-mocra)
化妝品之定義:「擦、倒、噴、灑於人體上,或以其他方式塗抹於人體上,用以清潔、美容、增進吸引力或改變外觀之物品」,定義中包含的產品有:護膚霜、保濕水、香水、唇膏、指甲油、眼睛和臉部化妝品、洗髮精、燙髮劑、染髮劑和除臭劑等,以及任何打算用作化妝品產品成分的物質。
※請注意:所有要註冊MoCRA的化妝品不可提到療效 (例如:抗痘、抗菌等…)
MoCRA化妝品分為1. 工廠註冊與2. 產品列名。
• 申請時間:工廠註冊資料齊全後(含FEI)約1週左右,產品列名視產品數量多寡而定。
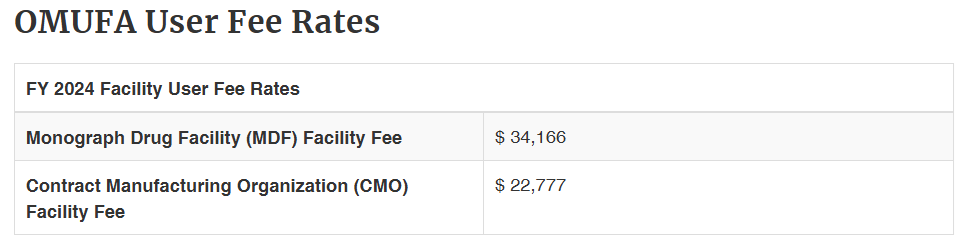
• 申請費用:
工廠註冊:
產品註冊:
過去三年在美國化妝品產品的平均年度銷售總額低於100萬美元(根據通貨膨脹調整)的負責人、設施所有者和經營者,並且不從事下述化妝品的製造或加工,應被視為小型企業,不受 MoCRA 有關良好生產規範、設施註冊和產品清單的要求的約束。
上述豁免不適用於從事製造或加工以下任何產品的任何負責人或設施: